クローン関連、細胞関連実験受託NanoBRET®解析
NanoBRET®検討用ベクター作製から解析まで受託を承っております。生物発光共鳴エネルギー転移(BRET : Bioluminescence Resonance Energy Transfer)は、生細胞におけるタンパク質間の直接的な相互作用を検出する手法として幅広く用いられています。類似の原理であるFRET(Förster resonance energy transfer)を用いた手法に比べて励起光を当てる必要がないので、バックグラウンド低減や細胞へのダメージを最小限に抑えることができます。
発光源に高レベル発光酵素NanoLuc® を用いたNanoBRET®システムは従来のウミシイタケルシフェラーゼを用いたBRETに比べ、より高い発光値と安定性、強固性を持ち、またHaloTag® NanoBRET® 618 fluorescent Ligandで標識されたHaloTag® タンパク質をエネルギー転移アクセプターとして利用することで従来のBRETに比べて優れたS/B比が得られます。
特徴
- ブルーシフトしたドナーシグナルとレッドシフトしたアクセプターにより従来のBRETよりも優れたS/B比を実現
- 生細胞アッセイによりリアルタイムでのタンパク質間相互作用を検出
- リバーシブルなアッセイ技術によりタンパク質間相互作用の誘導と阻害の両実験が可能
■ 生細胞リアルタイムPPIモニタリング
生物発光共鳴エネルギー移動(Bioluminescence resonance energy transfer)は、生細胞におけるタンパク間の直接的な相互作用を検出する手法として幅広く用いられています。類似の原理である FRET(Fluorescence resonance energy transfer)を用いた手法に比べ、励起光を当てる必要がないので、バックグラウンドがきわめて低く、励起光による細胞へのダメージを最小限に抑えることができます。
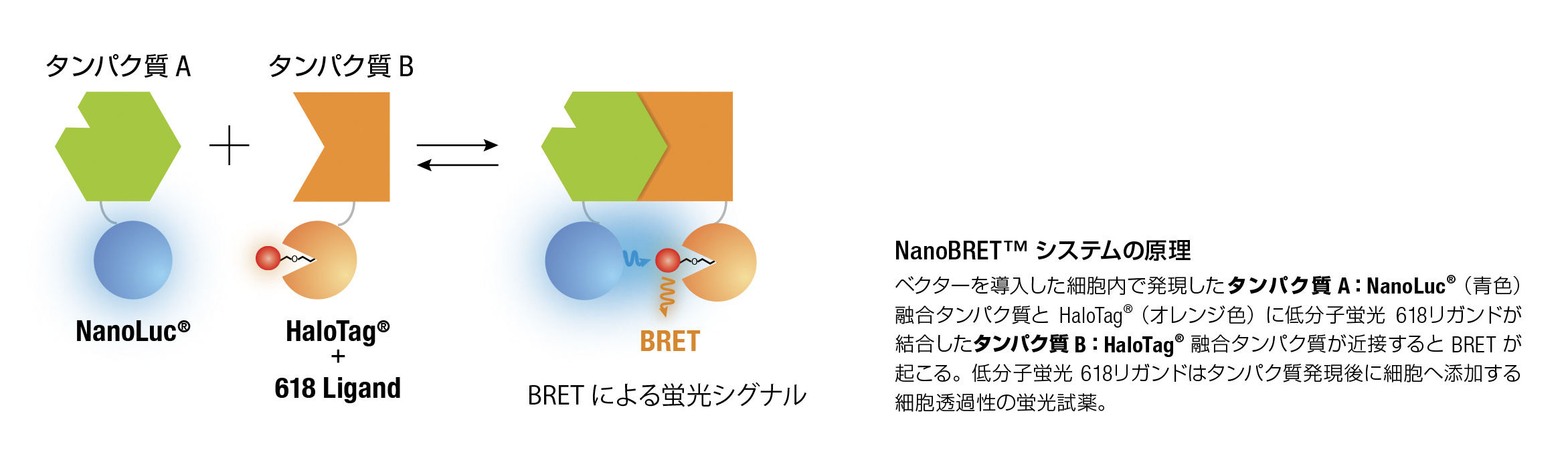
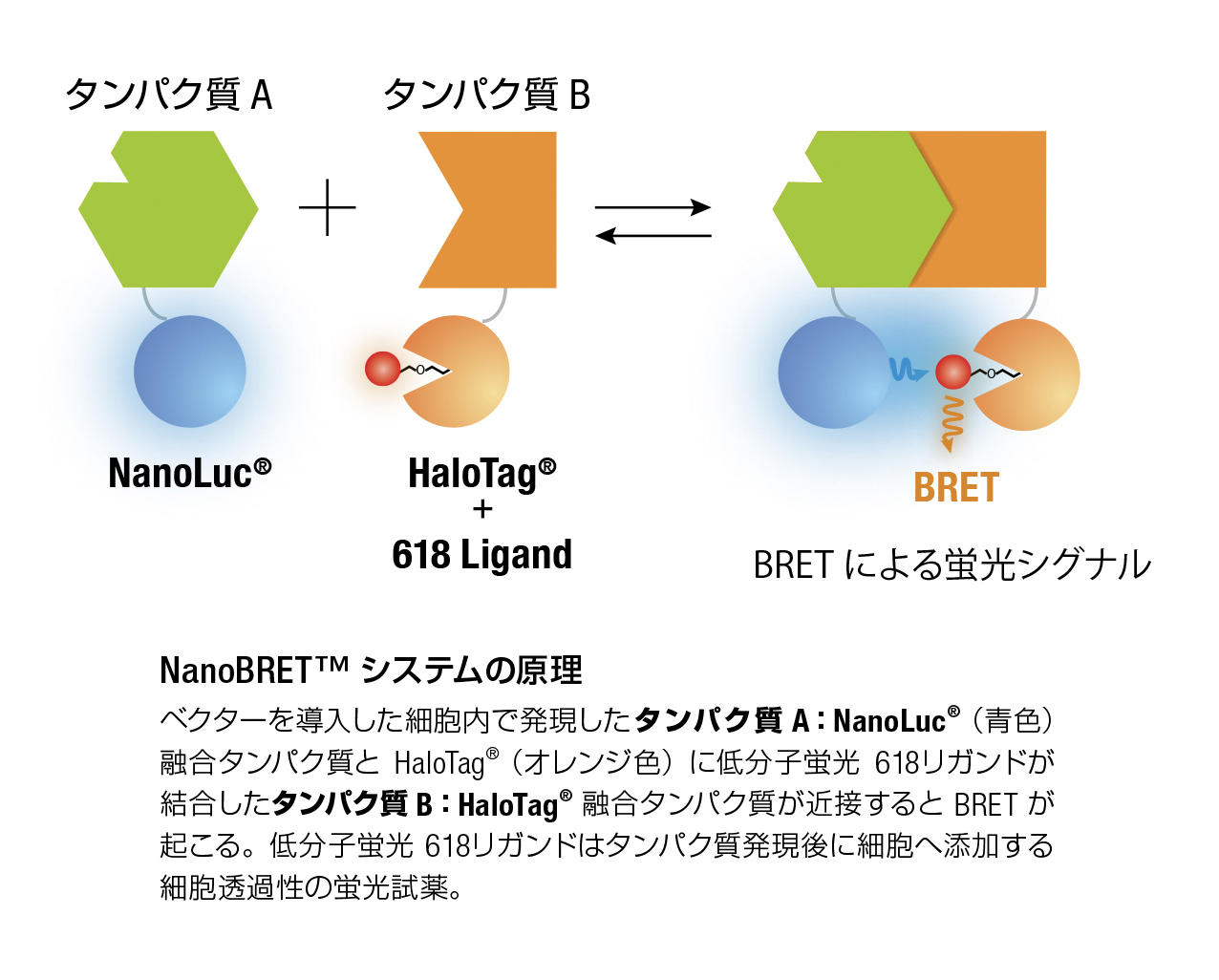
発光源に高レベル発光酵素 NanoLuc® を用いた NanoBRET™ system は従来のウミシイタケルシフェラーゼを用いた BRET に比べ、より高い発光値と安定性、強固性を持ち、またHaloTag® NanoBRET™ 618 uorescent Ligand で標識された HaloTag® タンパク質をエネルギー転移アクセプターとして利用することで従来の BRET に比べ優れたシグナル/ バックグラウンド比が得られます。生細胞でのリアルタイム解析、及びハイスループットスクリーニングに最適です。
■ 生細胞リアルタイムPPIモニタリング
生物発光共鳴エネルギー移動(Bioluminescence resonance energy transfer)は、生細胞におけるタンパク間の直接的な相互作用を検出する手法として幅広く用いられています。類似の原理である FRET(Fluorescence resonance energy transfer)を用いた手法に比べ、励起光を当てる必要がないので、バックグラウンドがきわめて低く、励起光による細胞へのダメージを最小限に抑えることができます。
発光源に高レベル発光酵素 NanoLuc® を用いた NanoBRET™ system は従来のウミシイタケルシフェラーゼを用いた BRET に比べ、より高い発光値と安定性、強固性を持ち、またHaloTag® NanoBRET™ 618 uorescent Ligand で標識された HaloTag® タンパク質をエネルギー転移アクセプターとして利用することで従来の BRET に比べ優れたシグナル/ バックグラウンド比が得られます。生細胞でのリアルタイム解析、及びハイスループットスクリーニングに最適です。

BRET に最適なスペクトルの分離とシグナル強度
新しい発光酵素 (HaloTag®:ピーク波長460 nm)と蛍光リガンド (618 Ligand:ピーク波長618 nm)により、シグナルの増強とスペクトルの分離が大幅に改善され、従来の FRET/BRET では得られなかったシグナル/ノイズ比を実現

従来の BRET アッセイと NanoBRET® のパフォーマンス比較
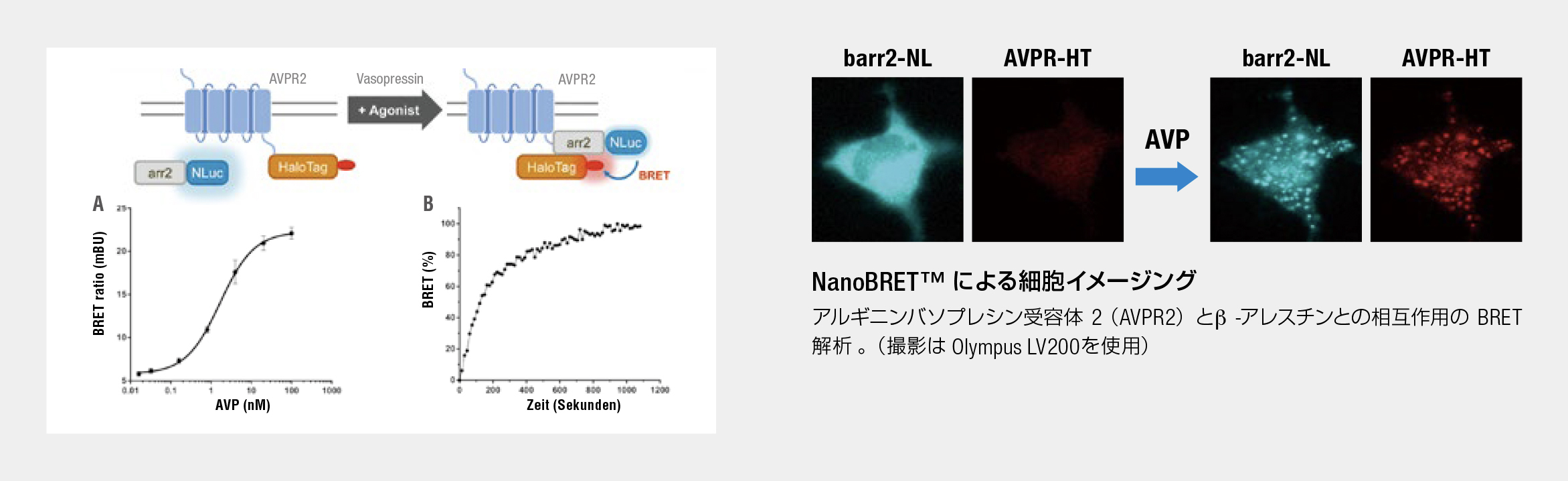
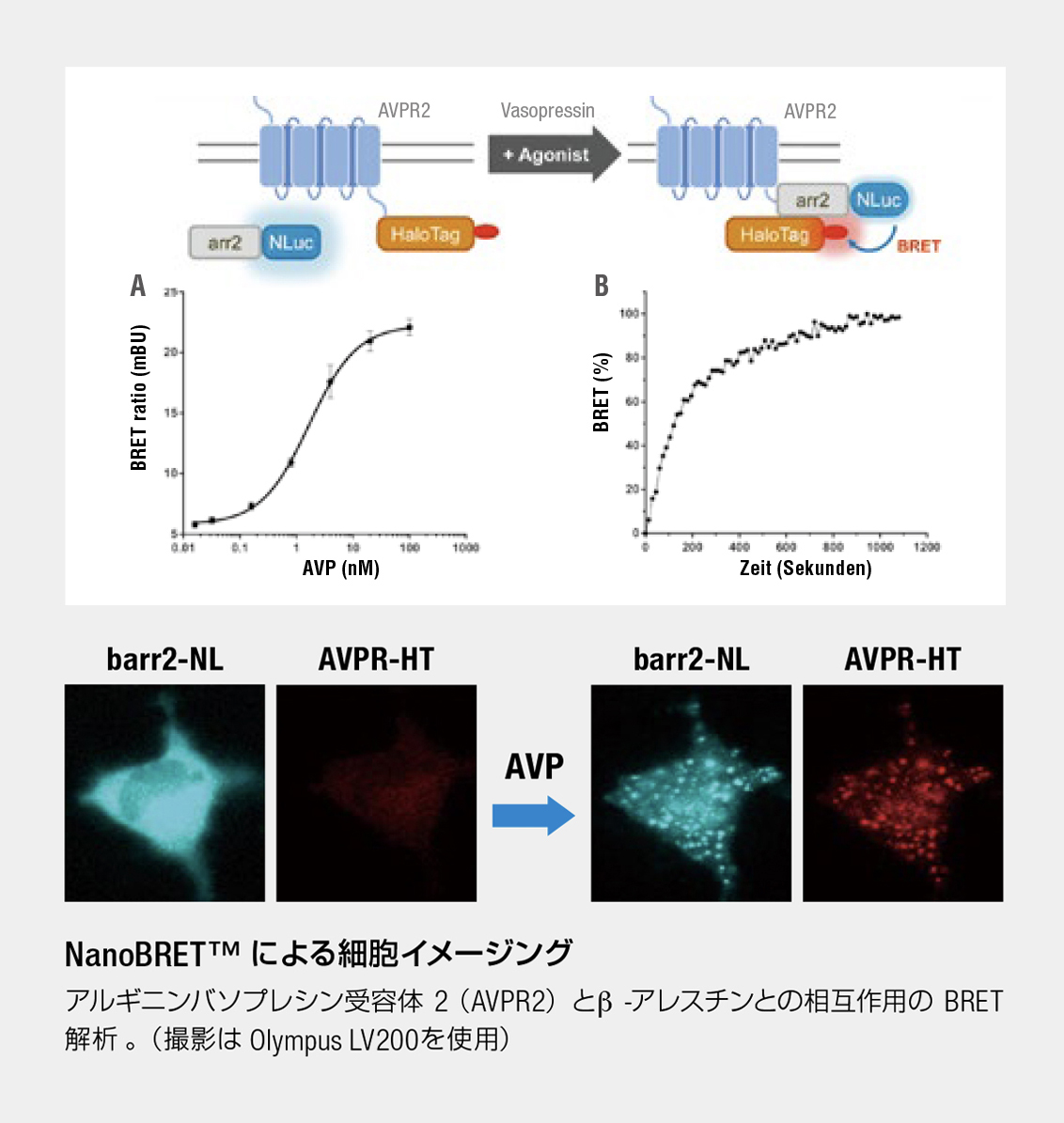
HaloTag® 618 Ligandが結合した FKBP-HaloTag® と FRB-NanoLuc® 存在下でラパマイシンを加えると2つの融合タンパク質が相互作用を起こし、BRET を生じる(左図)。FKBP-YFP と FRB-Rluc8 による BRET システムとのデータ比較
NanoBRET®, NanoBiT®解析(PPI解析)NanoBiT®解析
NanoBiT®検討用ベクター作製から解析まで受託を承っております。NanoLuc® Binary Technology(NanoBiT®)は生細胞内でタンパク質間の相互作用を構造的な相補性を利用して検出します。
NanoLuc® ルシフェラーゼをベースに作製されたLarge BiT(LgBiT)およびSmall BiT(SmBiT)の各サブユニットは構造的な安定性を高め、親和性が低くなるように最適化されています。目的タンパク質とLgBiTまたはSmBiTとの融合体を哺乳動物細胞内で発現させ、目的のタンパク質が相互作用すると構造的相補性が促進され明るい発光酵素が形成されます。細胞透過性の基質を添加すると生細胞でタンパク質の動態をリアルタイムで観察することができます。
特徴
- 生細胞でのタンパク質間相互作用のリアルタイム検出
- 従来のルシフェラーゼよりも輝度が高いため、内在レベルの発現量でも検出が可能
- 可逆的なタンパク質間相互作用解析に最適化されており、SmBiT-LgBiT間の非特異的な会合を最小限に抑制
■ ルミノメーターでできる生細胞リアルタイムPPIモニタリング
NanoLuc® Binary Technology(NanoBiT®)は生細胞内でタンパク質間の相互作用を構造的な相補性を利用して検出します。NanoLuc® ルシフェラーゼをベースに作製されたLarge BiT(LgBiT)およびSmall BiT(SmBiT)の各サブユニットは構造的な安定性を高め、親和性が低くなるように最適化されています。目的タンパク質とLgBiTまたはSmBiTとの融合体を哺乳動物細胞内で発現させ、目的のタンパク質が相互作用すると構造的相補性が促進され明るい発光酵素が形成されます。細胞透過性の基質を添加すると生細胞でタンパク質の動態をリアルタイムで観察することができます。
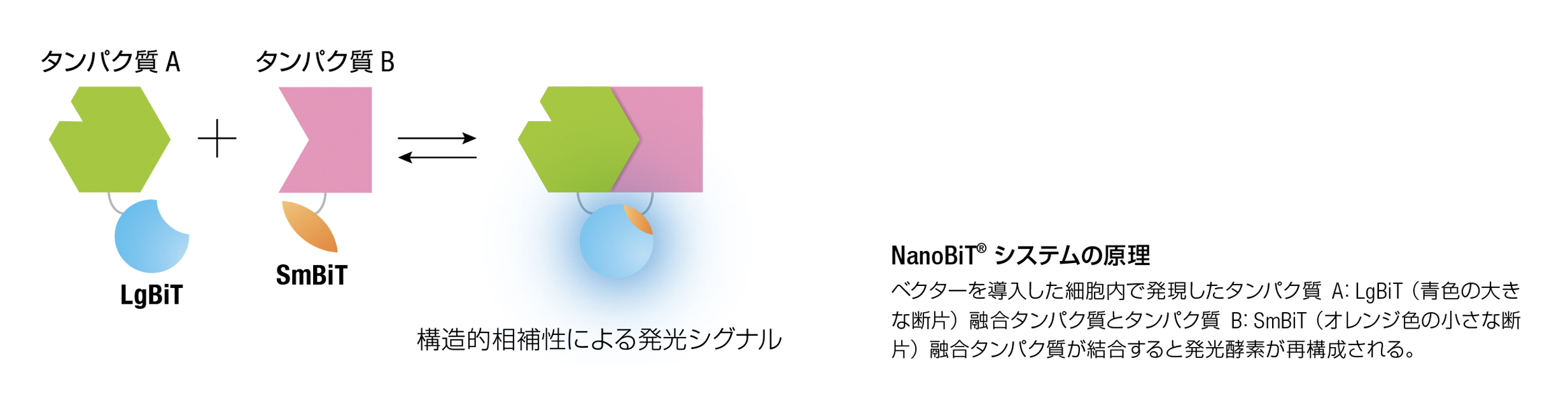
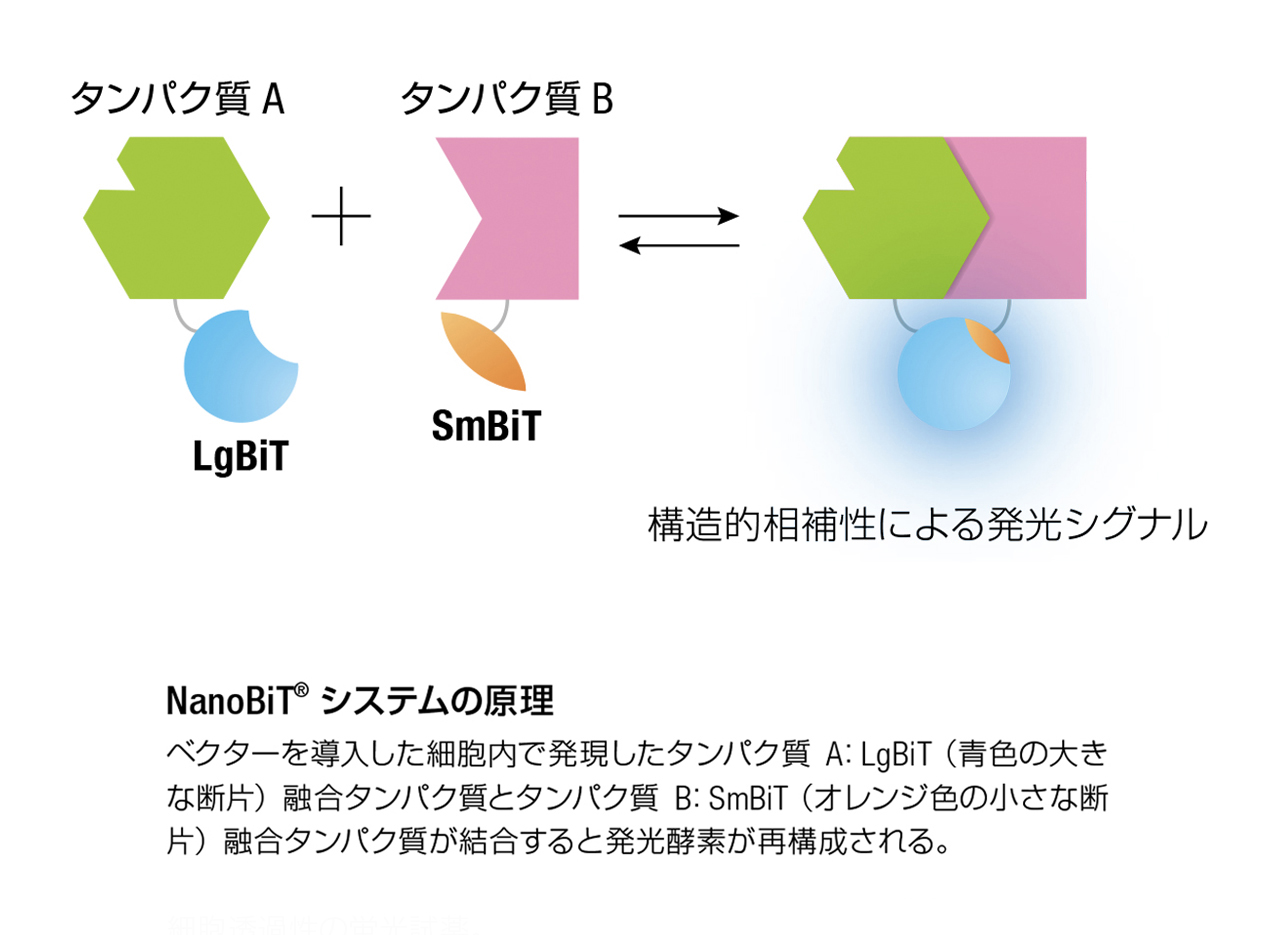

タンパク質間相互作用のダイナミクスをモニタリングできる NanoBiT® の可逆性
SmBiT-CA:LgBiT-R2A (PKA 触媒サブユニットあるいは調節サブユニットとNanoBiT®断片の融合タンパク質)を発現する HEK293細胞にイソプロ テレノール (ISO)、プロプラノール (PRO)または フォルスコリン (FSK)で順次刺激してタンパク質間相互作用を検出した

NanoBiT® とスプリットホタルルシフェラーゼの応答性の比較
NanoBiT® タグまたはスプリットホタルルシフェラーゼタグを融合したFKBPおよびFRBを発現するHEK293細胞にラパマイシン(上)またはFK506(下)を添加した

| クローニングセット |
|---|
| ご希望のタンパク質遺伝子を、複数の制限酵素サイトより選択してクローニングする標準的なMCSシステム、簡便な移し換えが可能なFlexiクローニング対応のFlexiシステムからお選びいただけます。 |
| NanoBiT® PPI MCS Starter System |
| NanoBiT® PPI Flexi® Starter System |
| コントロール |
|---|
| FKBP,FRBの各融合タンパク質を発現するベクターセット |
| NanoBiT® PPI Control Pair (FKBP, FRB) |
Copyright
- Flexi®, HaloTag®, NanoBiT®, NanoBRET®, NanoLuc®はプロメガ株式会社(Promega K.K.)の登録商標です。
- サイト内のプロメガ社の製品を用いて得られた図やデータについてはプロメガ株式会社(Promega K.K.)の許可を得て転載しています。
![[KGT] 株式会社かずさゲノムテクノロジーズ](../../../wp-content/uploads/2023/11/kazusagt_logo.png)
![[KGT] 株式会社かずさゲノムテクノロジーズ](../../../wp-content/uploads/2020/03/footer-logo-white.png)